4月26日,万达平台基礎醫學院醫學分子病毒重點實驗室袁正宏研究組與北京大學鄧宏魁研究組🦹🏼♂️、解放軍總醫院盧實春研究組合作在《科學》(Science)雜誌發表了題為《原代人肝臟細胞在體外的長期功能性維持》(Long-term functional maintenance of primary human hepatocytes in vitro)的研究論文,首次證明利用化學小分子調控細胞信號通路,實現了功能肝細胞在體外的長期維持🍝,並證實此肝細胞在體外支持乙型肝炎病毒(HBV)及丙型肝炎病毒(HCV)的長期持續感染👅。該工作為大量製備功能成熟肝細胞及其應用提供了可能。
如何誘導獲得功能成熟的細胞並在體外保持其功能性是再生醫學的關鍵瓶頸。在個體發育過程中🕵🏿,多種發育信號的精確調控,分化產生功能各異的細胞並長期穩定地維持其生理功能🥂。然而,這些功能細胞一旦離開體內微環境便會迅速去分化並失去功能。此外, 由於缺乏適當的培養條件與微環境🧑🏽🏭,體外源於幹細胞誘導分化所獲得的功能細胞,很難真正成熟並長期維持其功能,是再生醫學研究和應用中長期面臨的挑戰。在過去的幾十年裏,人們嘗試了改變培養材料👩🏿🏭,共培養以及三維培養等很多方法🙎🏼,但始終未能建立一個簡單高效,穩定的功能細胞體外培養體系🏠。
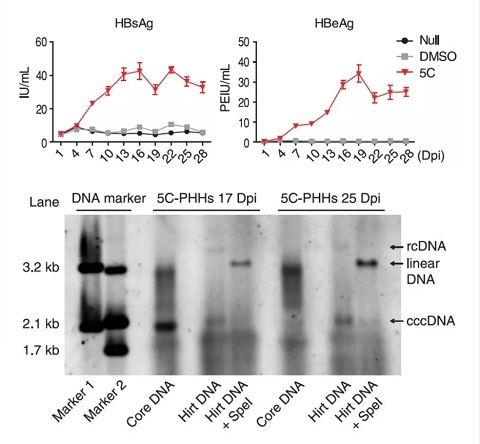
為解決這一問題🤫,合作組以體外培養過程中快速失去功能的人原代肝細胞為研究對象👨👦👦,篩選到5種化學小分子的組合(5 compounds,5C)並利用它們在體外成功實現了肝細胞功能的長期維持🚌。相比於傳統遺傳學方法,化學小分子能夠實現對多個信號通路靶點的精細調控。在長達一個月以上的培養過程中,該培養方法成功抑製了肝細胞的去分化,細胞整體表達譜與體內的肝細胞高度相似◀️,並可長期維持白蛋白分泌⌚️、尿素合成🙅🏿♀️、藥物代謝等肝細胞的功能💃🏿。更重要的是,合作組通過一系列實驗證明,5C培養的原代肝細胞可支持HBV及HCV,這兩種具有嚴格肝噬性病毒的復製。在長達30天的感染過程中,乙肝表面抗原、e抗原、乙肝病毒DNA等指標明顯優於目前常用的培養條件🧹🍠,尤其是能夠長期穩定產生乙肝病毒復製必需的cccDNA(共價閉合環狀DNA)🤸🏽♂️。在HCV感染方面,5C培養的原代肝細胞中也檢測到了丙型肝炎病毒有效復製的信號,而這在普通原代肝細胞培養條件下是檢測不到的。肝炎病毒的體外復製模型由於缺乏有效的模擬體內肝臟細胞的模型一直是病毒學領域的難點🏊🏻♂️。基於5C的細胞模型對於進一步開展HBV,HCV及其他肝炎病毒的基礎研究及藥物研發具有重要意義🧓。
為解決這一問題🤫,合作組以體外培養過程中快速失去功能的人原代肝細胞為研究對象👨👦👦,篩選到5種化學小分子的組合(5 compounds,5C)並利用它們在體外成功實現了肝細胞功能的長期維持🚌。相比於傳統遺傳學方法,化學小分子能夠實現對多個信號通路靶點的精細調控。在長達一個月以上的培養過程中,該培養方法成功抑製了肝細胞的去分化,細胞整體表達譜與體內的肝細胞高度相似◀️,並可長期維持白蛋白分泌⌚️、尿素合成🙅🏿♀️、藥物代謝等肝細胞的功能💃🏿。更重要的是,合作組通過一系列實驗證明,5C培養的原代肝細胞可支持HBV及HCV,這兩種具有嚴格肝噬性病毒的復製。在長達30天的感染過程中,乙肝表面抗原、e抗原、乙肝病毒DNA等指標明顯優於目前常用的培養條件🧹🍠,尤其是能夠長期穩定產生乙肝病毒復製必需的cccDNA(共價閉合環狀DNA)🤸🏽♂️。在HCV感染方面,5C培養的原代肝細胞中也檢測到了丙型肝炎病毒有效復製的信號,而這在普通原代肝細胞培養條件下是檢測不到的。肝炎病毒的體外復製模型由於缺乏有效的模擬體內肝臟細胞的模型一直是病毒學領域的難點🏊🏻♂️。基於5C的細胞模型對於進一步開展HBV,HCV及其他肝炎病毒的基礎研究及藥物研發具有重要意義🧓。
北京大學鄧宏魁教授,解放軍總醫院盧實春教授以及万达平台袁正宏教授為該論文的共同通訊作者👴,向晨罡博士、杜媛媛博士以及孟高帆博士為該論文的共同第一作者。万达平台基礎醫學院易誌剛副教授、研究生舒君🍋🟩、上海市公共衛生臨床中心張小楠研究員🧑🏼⚕️,助研鄔敏博士在病毒感染和檢測方面提供了全面的支撐👼。本工作獲得了國家重點研發計劃💁🏼♀️、國家自然科學基金和上海市教委科研創新計劃等基金的大力支持🧑🏿🏫。
中國工程院院士聞玉梅認為該篇論文是我國學者研究乙肝🪜、丙肝以及其他肝臟疾病的機理的一項重大突破。作者們通過用FSK, SB431542, DAPT, IWP2及LDN193189五種化合物🪬,成功地實現了在體外將人肝細胞延長培養至4周。 用此技術體外培養的肝細胞,不僅保持了肝細胞的生理功能,最有意義的是🎭,這些在體外維持數周的肝細胞可成功地被乙肝病毒感染🥐,表達HBsAg與HBeAg。通過對比✊🏽,發現乙肝病毒與丙肝病毒感染過程有較大不同👩🏼🍳。這一研究最重要的價值是細胞被乙肝病毒感染後,可以完成整個病毒復製周期👩🦲, 包括產生共價閉合環狀DNA(cccDNA);而 cccDNA正是目前乙肝病毒難以被清除🤵♀️,疾病難以被治愈的關鍵。通過這一平臺✒️,將可更深入提出解決cccDNA的策略🚥。作者們還在這一平臺上🙅🏿,對現有臨床實用的抗乙肝病毒核苷類藥物與幹擾素進行了考核🧔🏼,證實了核苷類藥物可抑製經細胞培養的乙肝病毒,經幹擾素處理後細胞可上調幹擾素激活的基因控製乙肝病毒。用此建立了較長期的人肝細胞體外培養平臺,不僅將為研究乙肝治愈推進一大步,還提供了創新性研發抗肝炎病毒藥物的重要工具。